Le reazioni chimiche - reazioni di doppio scambio- esercizi risolti (2)
Questi esercizi fanno riferimento alla teoria trattata nei post precedenti:- Le reazioni di scambio doppio - con formazione di gas
- Le reazioni di neutralizzazione - con formazione di acqua
- Le reazioni di doppio scambio - con formazione di precipitati
- Una spiegazione dettagliata della procedura è nel post precedente.
2- Scrivi i reagenti necessari per ottenere i prodotti delle seguenti reazioni di precipitazione
Questo tipo di problemi sono l'inverso di quelli visti nel post precedente. Per cui non mi soffermerò sulla discussione dei dettagli della procedura. In questo caso non dobbiamo preoccuparci di capire quale sarà il precipitato ma solo individuare i reagenti della reazione.Per cui faremo riferimento alla classificazione delle reazioni con formazione di precipitati.
- Le reazioni di doppio scambio - con formazione di precipitati
-Scrivo le formule (in questo caso dei prodotti)
-Determino gli ioni coinvolti nel doppio scambio
-Bilancio direttamente gli ioni
-Scrivo la reazione completa
A- prodotti: idrossido rameico e cloruro di sodio
I reagenti saranno stati quindi un Sale e un idrossido solubile: sono sempre reazioni di doppio scambio
Individuiamo gli ioni e bilanciamoli
Lo ione rameico (2 cariche positive) neutralizza i due ioni Cloruro Cl- mentre l'drossido di partenza era l'idrossido di Sodio, 2 unità entrano nella reazione.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
I reagenti di una reazione di doppio scambio che ha come prodotti idrossido rameico e cloruro di sodio sono il Cloruro Rameico e l'Idrossido di Sodio.
B- Nitrato di Zinco + Solfato Piomboso
I prodotti sono due sali uno solubile, il Nitrato di Zinco e uno insolubile, il Solfato Piomboso.
I reagenti saranno stati quindi due sali solubili: sono sempre reazioni di doppio scambio
Individuiamo gli ioni e bilanciamoli
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
I reagenti di una reazione di doppio scambio che ha come prodotti Solfato Piomboso e Nitrato di Zinco sono il Solfato di Zinco e il Nitrato Piomboso.
C- Cloruro di Argento e Perclorato di Potassio
I prodotti sono due sali uno solubile, il Perclorato di Potassio e uno insolubile, il Cloruro di Argento.
I reagenti saranno stati quindi due sali solubili: sono sempre reazioni di doppio scambio
Individuiamo gli ioni e bilanciamoli
Lo Ione Potassio K+ (1 carica positiva) si neutralizza completamente con uno Cloruro Cl-. Lo ione Argento Ag+ può associarsi allo ione Perclorato ClO4-.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
I reagenti di una reazione di doppio scambio che ha come prodotti Cloruro di Argento e Perclorato di Potassio sono il Perclorato di Argento e il Cloruro di Potassio
D- Ioduro Mercurico + Nitrato di Potassio
I reagenti saranno stati quindi due sali solubili: sono sempre reazioni di doppio scambio
Individuiamo gli ioni e bilanciamoli
Lo Ione Mercurico Hg++ (2 cariche positive) si neutralizza completamente con due ioni Nitrato NO3-. Due ioni Potassio K+ possono associarsi ai due ioni Ioduro I-.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
E- Carbonato Manganoso + Solfato di Potassio
I reagenti saranno stati quindi due sali solubili: sono sempre reazioni di doppio scambio
Individuiamo gli ioni e bilanciamoli
Lo Ione Manganoso Mn++ (2 cariche positive) si neutralizza completamente con uno ione Solfato SO4--. Due ioni Potassio K+ possono associarsi con lo Ione Carbonato CO3--.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
Ricapitolando:
- In questo tipo di esercizi viene data una semireazione da completare con i prodotti di reazione noti.
- 1- dato che sono reazioni di doppio scambio il primo passo è scomporre le sostanze nei singoli ioni
- Se non si riescono a riconoscere gli ioni per esperienza, conviene sempre partire dallo ione metallico. Se il metallo è del primo secondo o del terzo gruppo non ci sono problemi. La sua carica corrisponde al gruppo. Se il metallo è di transizione o del quarto gruppo la risposta non è così immediata in quanto possono assumere più valori del numero di ossidazione e occorre un po' di esperienza.
- Per quanto riguarda gli anioni, i monoatomici, alogenuri o solfuri, hanno rispettivamente una o due cariche negative, gli idrossidi OH sempre una carica negativa. Per i poliatomici che derivano dagli ossiacidi occorre un po' di esperienza.
- 2- si possono bilanciare le reazioni direttamente in forma ionica, niente impedisce di farlo alla fine ma così è più facile
- 3- Per ottenere i reagenti si scambiano di posto gli ioni delle sostanze
- 4- Non c'è il problema di determinare le solubilità in quanto i reagenti, dato il tipo di reazione, devono essere entrambi solubili in acqua.
VEDI ANCHE:
-
Le reazioni chimiche - reazioni di sintesi (1)
-
Le reazioni chimiche - reazioni di sintesi (2)
-
Reazioni di sintesi - problemi risolti (1)
-
Reazioni di sintesi - problemi risolti (2)
- Le reazioni di decomposizione
- Le reazioni di scambio semplice
- Le reazioni di scambio doppio
- Le reazioni di scambio doppio - reazioni di neutralizzazione
- Le reazioni di scambio doppio - formazione di precipitati
- Le reazioni di scambio doppio - esercizi risolti (1)
- Le reazioni di scambio doppio - esercizi risolti (2)



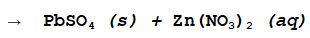











Nessun commento:
Posta un commento