Le reazioni chimiche - reazioni di doppio scambio- esercizi risolti
Questi esercizi fanno riferimento alla teoria trattata nei post precedenti:- Le reazioni di scambio doppio - con formazione di gas
- Le reazioni di neutralizzazione - con formazione di acqua
- Le reazioni di doppio scambio - con formazione di precipitati
1- Completa e bilancia le seguenti reazioni e indica con (s) la formazione del precipitato.
In questo caso ci dice chiaramente che sono reazioni che formano precipitati in soluzione acquosa, per cui rientrano nel terzo caso.Prima di tutto completiamo le equazioni di reazione e poi pensiamo a quale dei prodotti può essere il precipitato.
A- Cloruro Ferrico + Idrossido di Sodio
Il Cloruro Ferrico è un sale (il Ferro ha il numero massimo di ossidazione +3 per cui il cloruro si chiama Ferrico) e l'Idrossido di Sodio è, ovviamente, un idrossido, una base.
Entrambi sono composti ionici per cui si dissociano in soluzione acquosa nelle rispettive forme ioniche.
I prodotti saranno dati dal doppio scambio dei cationi e degli anioni dei composti di partenza.
Individuiamo gli ioni
Allo ione Ferrico (3 cariche positive) occorrono tre OH- per neutralizzare le cariche, mentre ogni ione Sodio Na+ può associarsi a un singolo ione Cloruro Cl- per neutralizzare l'unica carica positiva che possiede.
Questo vuol dire che per ogni unità di Cloruro Ferrico occorrono tre unità di Idrossido di Sodio per completare la reazione.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
Da una reazione di doppio scambio tra un sale e un idrossido si formano un altro sale e un altro idrossido, in questo caso il Cloruro di Sodio e l'Idrossido Ferrico.
Ma quale dei due precipita?
Dobbiamo ricordare alcune delle regole puntualizzate nel post precedente.
1- I metalli del primo gruppo e lo ione ammonio formano composti solubili con rare eccezioni, non importa quale sia l'anione.
2- Gli idrossidi sono insolubili tranne quelli del punto 1 e del calcio.
Per cui il Cloruro di Sodio è sicuramente solubile mentre L'Idrossido Ferrico precipita!
B- Cloruro di Bario + Solfato di Potassio
Il Cloruro di Bario è un sale binario (il Bario è un elemento del secondo gruppo per cui ha in ogni composto una carica doppia positiva) e anche il Solfato di Potassio è un sale, ternario.
Entrambi sono composti ionici per cui si dissociano in soluzione acquosa nelle rispettive forme ioniche.
I prodotti saranno dati dal doppio scambio dei cationi e degli anioni dei composti di partenza.
Individuiamo gli ioni
Lo ione Bario (2 cariche positive) si neutralizza completamente con uno ione Solfato SO4--. Lo ione Potassio K+ può associarsi a un singolo ione Cloruro Cl- per neutralizzare l'unica carica positiva che possiede.
Questo vuol dire che la reazione avviene in un rapporto 1:1. Però si formeranno due unità di Cloruro di Potassio
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
Da una reazione di doppio scambio tra due sali si formano altri due sali: in questo caso il Cloruro di Potassio e il Solfato di Bario
Ma quale dei due precipita?
Dobbiamo ricordare alcune delle regole puntualizzate nel post precedente.
1- I metalli del primo gruppo e lo ione ammonio formano composti solubili con rare eccezioni, non importa quale sia l'anione.
2- i Solfati sono quasi tutti solubili tranne quelli di Bario e di Rubidio
Per cui il Cloruro di Potassio è sicuramente solubile mentre il Solfato di Bario precipita!
C- Nitrato Piomboso + Cromato di Sodio
Il Nitrato Piomboso è un sale ternario (il Piombo ha il numero di ossidazione più basso +2 per cui il Nitrato è Piomboso) come pure il Cromato di Sodio.
Entrambi sono composti ionici per cui si dissociano in soluzione acquosa nelle rispettive forme ioniche.
I prodotti saranno dati dal doppio scambio dei cationi e degli anioni dei composti di partenza.
Individuiamo gli ioni
Lo ione Piomboso (2 cariche positive) si neutralizza completamente con uno ione Cromato CrO4--. Lo ione Sodio Na+ può associarsi a un singolo ione Nitrato NO3- per neutralizzare l'unica carica positiva che possiede.
Questo vuol dire che la reazione avviene in un rapporto 1:1. Però si formeranno due unità di Nitrato di Sodio
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
Da una reazione di doppio scambio tra due sali si formano altri due sali: in questo caso il Cromato Piomboso e il Nitrato di Sodio
Ma quale dei due precipita?
Questa è un po' più difficile. Dobbiamo ricordare alcune delle regole puntualizzate nel post precedente.
1- I metalli del primo gruppo e lo ione ammonio formano composti solubili con rare eccezioni, non importa quale sia l'anione.
2- Cloruri, Bromuri, Nitrati e acetati sono quasi tutti solubili
In questo caso per i punti 1 e 2 possiamo dire con certezza che il Nitrato di Sodio è sicuramente solubile e quindi è il Cromato Piomboso che precipita!
Il Cromato Piomboso si può trovare in natura come minerale: la Crocoite.
 |
| Cristalli di Crocoite: https://www.mindat.org/photo-998966.html - Copyright Jean Dehaye |
D- Nitrato di Argento + Solfuro di Sodio
Entrambi sono composti ionici per cui si dissociano in soluzione acquosa nelle rispettive forme ioniche.
I prodotti saranno dati dal doppio scambio dei cationi e degli anioni dei composti di partenza.
Individuiamo gli ioni
Allo ione Solfuro (2 cariche negative) occorrono DUE ioni argento Ag+ per neutralizzare le cariche, mentre ogni ione Sodio Na+ può associarsi a un singolo ione Nitrato NO3- per neutralizzare l'unica carica positiva che possiede.
Questo vuol dire che per ogni unità di Solfuro di Sodio occorrono due unità di Nitrato di Argento per completare la reazione.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
Ma quale dei due precipita?
Dobbiamo ricordare alcune delle regole puntualizzate nel post precedente.
1- I metalli del primo gruppo e lo ione ammonio formano composti solubili con rare eccezioni, non importa quale sia l'anione.
2- Cloruri, Bromuri, Nitrati e acetati sono quasi tutti solubili
3- I Solfuri sono solubili se con cationi di elementi del primo o secondo gruppo o lo ione ammonio
In questo caso per i punti 1 e 2 possiamo dire con certezza che il Nitrato di Sodio è sicuramente solubile e quindi è il Solfuro di Argento che precipita!
E- Carbonato di Sodio + Cloruro Rameico
Entrambi sono composti ionici per cui si dissociano in soluzione acquosa nelle rispettive forme ioniche.
I prodotti saranno dati dal doppio scambio dei cationi e degli anioni dei composti di partenza.
Individuiamo gli ioni
Lo ione Rameico (2 cariche positive) può essere neutralizzato da uno ione Carbonato, mentre ogni ione Sodio Na+ può associarsi a un singolo ione Cloruro Cl- per neutralizzare l'unica carica positiva che possiede.Questo vuol dire che i 2 sali reagiscono in rapporto 1:1, ma si formeranno due unità di Cloruro di Sodio alla fine della reazione per ogni unità di Carbonato Rameico che si ottiene.
Ora possiamo scrivere l'equazione di reazione completa e bilanciata.
Ma quale dei due precipita?
Dobbiamo ricordare alcune delle regole puntualizzate nel post precedente.
1- I metalli del primo gruppo e lo ione ammonio formano composti solubili con rare eccezioni, non importa quale sia l'anione.
2- Carbonati e solfiti sono quasi tutti INSOLUBILI tranne quelli del punto 1
3- Cloruri, Bromuri, Nitrati e acetati sono quasi tutti solubili
In questo caso per i punti 1 e 2 possiamo dire con certezza che il Cloruro di Sodio è sicuramente solubile (come sappiamo tutti) e che il Carbonato Rameico precipita!
Ricapitolando:
- In questo tipo di esercizi viene data una semireazione da completare
- Si tratta di reazioni di precipitazione per cui almeno uno dei due prodotti è INSOLUBILE e precipita dalla soluzione
- 1- dato che sono reazioni di doppio scambio il primo passo è scomporre le sostanze nei singoli ioni
- Se non si riescono a riconoscere gli ioni per esperienza, conviene sempre partire dallo ione metallico. Se il metallo è del primo secondo o del terzo gruppo non ci sono problemi. La sua carica corrisponde al gruppo. Se il metallo è di transizione o del quarto gruppo la risposta non è così immediata in quanto possono assumere più valori del numero di ossidazione e occorre un po' di esperienza.
- Per quanto riguarda gli anioni, i monoatomici, alogenuri o solfuri, hanno rispettivamente una o due cariche negative, gli idrossidi OH sempre una carica negativa. Per i poliatomici che derivano dagli ossiacidi occorre un po' di esperienza.
- 2- si possono bilanciare le reazioni direttamente in forma ionica, niente impedisce di farlo alla fine ma così è più facile
- 3- Per ottenere i prodotti si scambiano di posto gli ioni delle sostanze
- 4- per capire quale dei prodotti è quello che precipita occorre ragionare sulle regole generali che determinano la solubilità di un sale.
VEDI ANCHE:
-
Le reazioni chimiche - reazioni di sintesi (1)
-
Le reazioni chimiche - reazioni di sintesi (2)
-
Reazioni di sintesi - problemi risolti (1)
-
Reazioni di sintesi - problemi risolti (2)
- Le reazioni di decomposizione
- Le reazioni di scambio semplice
- Le reazioni di scambio doppio
- Le reazioni di scambio doppio - reazioni di neutralizzazione
- Le reazioni di scambio doppio - formazione di precipitati
- Le reazioni di scambio doppio - esercizi risolti (1)
- Le reazioni di scambio doppio - esercizi risolti (2)


















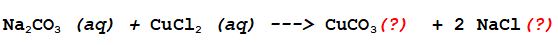

Nessun commento:
Posta un commento