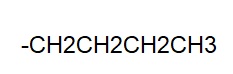martedì 18 aprile 2023
lunedì 17 aprile 2023
I Margini Convergenti - geologia - 2023
I Margini Convergenti - geologia - 2023
I MARGINI CONVERGENTI
Sono i confini che delimitano due placche che si stanno scontrando.
In questi margini, la roccia oceanica, se presente, sprofonda (SUBDUZIONE) sotto la crosta continentale più leggera e meno densa.
Per questo si chiamano anche DISTRUTTIVI, perché distruggono la vecchia crosta.
I MARGINI CONVERGENTI si possono formare quando si scontrano due placche oceaniche , una placca oceanica e una continentale e due placche continentali.
testo qui
Le Fosse Oceaniche: Le fosse oceaniche sono un segno della presenza di un margine convergente. Dalla fossa oceanica la crosta oceanica sprofonda lungo un piano inclinato chiamato piano di Benioff |
Caso 1: placca oceanica - placca oceanica
Quando si scontrano due placche oceaniche la più vecchia e densa scivola sotto quella più recente
Lungo il piano di subduzione le rocce si fondono e si formano dei pennacchi di magma che risalgono in superficie
Si forma quindi, lungo il margine, una serie di isole vulcaniche.
L’oceano piano piano si restringe, se non c’è una dorsale a sostenerlo e alla fine si fonderanno due continenti.
Convergent Boundary: Margine convergente
Dove li troviamo?
FENOMENI VULCANICI E SISMICI LUNGO IL MARGINE
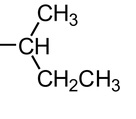
I radicali alchilici più comuni - Il sec-Butile - 2023
I radicali alchilici più comuni - Il sec-Butile
I radicali alchilici più comuni
sec-BUTILE: è il radicale che si forma quando sottraggo un atomo di idrogeno a un carbonio interno (secondario in quanto lega altri due atomi di carbonio) della catena del BUTANO.
giovedì 13 aprile 2023
I Margini Divergenti - scienze della terra - 2023
I Margini Divergenti - scienze della terra - 2023
I MARGINI DIVERGENTI
Sono i confini che delimitano due placche che si stanno ingrandendo.
In questi margini, viene emessa continuamente lava che costruisce nuova crosta e spinge lontano la vecchia.
Per questo si chiamano anche COSTRUTTIVI, perché costruiscono nuova crosta.
I MARGINI DIVERGENTI ben formati, maturi, sono le DORSALI OCEANICHE.
Quelli in formazione sono le RIFT VALLEY continentali.
Rift Valley Continentale, le prime fasi di formazione di un margine divergente. Il magma che risale dall’Astenosfera, spacca e fa sprofondare la crosta soprastante. Dove posso osservare questo fenomeno?La grande RIFT VALLEY Africana sta lentamente, occorreranno milioni di anni, spaccando in due il continente. Tutta la parte orientale dell’Africa è destinata a staccarsi dal resto. Quando il processo andrà avanti il mare entrerà dentro l’Africa, fino a quando non si formerà un nuovo Oceano
FENOMENI SISMICI E VULCANICI LUNGO IL MARGINE
Vediamo il processo in un breve videoIn questa breve simulazione, 20 milioni di anni, vediamo come si forma in mezzo a un continente una RIFT VALLEY, come in Africa, poi uno stretto mare, e poi la catena di vulcani sottomarini che è diventata una DORSALE OCEANICA. Divergent Boundary = Margine Divergente Plate= placca |
domenica 2 aprile 2023
Simulazione della propagazione delle onde sismiche - geologia - 2023
Simulazione della propagazione delle onde sismiche - geologia - 2023
L’energia di un Terremoto, scaturita dall'Ipocentro, si propaga in tutto il pianeta anche se, man mano che ci allontaniamo dall’Ipocentro e dall’Epicentro, perde potenza.
- Sono onde di materia ed energia (come le onde del mare o le onde sonore)
Si propagano solo attraverso la materia
Senza materia non possono propagarsi
più la materia è compatta ed elastica più è alta la loro velocità di propagazione
si propagano nell’intero pianeta ma perdono forza man mano che ci si allontana dall’Ipocentro-Epicentro.
Le Onde Sismiche non sono tutte uguali.
Esistono tre tipi diversi di onde:
Le onde P o prime: sono le onde più veloci che si originano dall’ipocentro, all’interno della crosta terrestre. Si propagano nei solidi e nei fluidi
Le onde S o seconde: sono generate dalle onde P mentre passano attraverso le rocce della crosta. Sono più lente delle prime. Si propagano solo nei solidi, per cui vengono smorzate o annichilite quando attraversano gli strati semifluidi o fluidi interni al nostro pianeta, come ad esempio il nucleo esterno.
Onde Superficiali: si scatenano quando le onde interne, P e S, raggiungono la superficie. Qui non c’è nulla che tenga bloccate le rocce, c’è aria o acqua, quindi le oscillazioni diventano estreme. Sono quelle che causano le principali distruzioni dei Terremoti. Ne esistono di due tipi a seconda della morfologia delle oscillazioni: di Love associate a fenomeni ondulatori e di Rayleigh associate a fenomeni sussultori.
Nella simulazione del video la propagazione delle onde sismiche del terremoto del 18 agosto 1999, Izmit Turchia
Il terremoto ebbe una magnitudo momento di 7,6 e un'intensità massima della scala Mercalli di IX. L'evento è durato 37 secondi
Si può apprezzare la maggiore velocità delle onde P che guadagnano terreno sulle onde S man mano che si allontanano dall'ipocentro.
canale youtube
I radicali alchilici più comuni - Il Butile
I radicali alchilici più comuni - Il Butile
I radicali alchilici più comuni
BUTILE: è il radicale che si forma quando sottraggo un atomo di idrogeno al PRIMO carbonio della catena del BUTANO.
Calcolare la Molarità di una soluzione conoscendo la molalità e la densità - chimica - 2023
Calcolare la Molarità di una soluzione conoscendo la molalità e la densità - chimica - 2023
esercizi svolti, livello medio/difficile
inserita il 23-03-2023
formulario
“ Le formule che dobbiamo usare „
Per la teoria sulla Molalità ed esercizi più semplici consultate le pagine: molalità e concentrazione molale; esercizi svolti sulla molalità (1) esercizi svolti sulla molalità (2) eesercizi svolti sulla molalità (3)
Ricordiamo le formule che ci servono e le grandezze coinvolte in questi esercizi
La Molalità (m) di una sostanza è uguale al numero di moli della sostanza (n) divisa per la massa del solvente espressa in chilogrammi (Kg o msolv)
m = n / Kg
La Molarità (M) di una sostanza è uguale al numero di moli della sostanza (n) divisa per il Volume (V) della SOLUZIONE espresso in Litri:
M = n / V
La Densità (d) di una soluzione è uguale ala massa COMPLESSIVA (massa soluto + massa solvente) divisa per il Volume occupato dalla soluzione: può essere espressa in diverse unità di misura a seconda delle esigenze Kg/m3;Kg/L; g/cm3
d = m / V
Il numero di moli (n) di una sostanza è uguale alla massa della sostanza (mg) espressa in grammi, divisa per la massa molare (Mm) della sostanza in grammi per mole:
n = mg / Mm
La massa della sostanza (mg) espressa in grammi è uguale al numero di moli (n) della sostanza moltiplicato per la massa molare (Mm) della sostanza in grammi per mole:
mg = n x Mm
La massa molecolare (Mm) di una sostanza la ricaviamo dalla tavola periodica ed è uguale alla somma delle masse atomiche dei singoli atomi che compongono la molecola, espresse in unità di massa atomica (uma):
Mm = (numero di atomi elemento1 x uma1) + (numero di atomi elemento2 x uma2) + (numero di atomi elemento3 x uma3) + ...
.
Esercizio 1
Calcolare la molarità di una soluzione di acido perclorico 0.175 m, sapendo che la densità della soluzione è 1.18 g/ml
NB: In questo tipo di esercizi bisogna utilizzare i dati della concentrazione nota, in questo caso la molalità per ricavare i dati della soluzione a concentrazione ignota, in questo caso la molarità
Dato che la Molarità fa riferimento al VOLUME della soluzione e la Molalità ai CHILOGRAMMI di solvente, ci occorre sempre la densità per mettere i relazione le due grandezze.
Procediamo come nell'esercizio precedente e utilizziamo delle tabelle a due colonne in modo da confrontare graficamente e rapidamente le due concentrazioni.
Riempiamo la tabella con i termini della concentrazione nota e poi riempiamo la seconda tabella con i dati della concentrazione ignota
Ovviamente la quantità di soluto come pure la densità sono gli stessi per le due concentrazioni per cui riempiamo contemporaneamente le due colonne man mano che li ricaviamo o ci vengono forniti.
Impostiamo una tabella con i dati a nostra disposizione.
| Ignota (Molarità) | Nota (Molalità) | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | ? | mol/L | Molalità | 0,175 | mol/Kg |
| Numero di Moli | ? | mol | Numero di Moli | ? | mol |
| Massa in grammi | ? | g | Massa in grammi | ? | g |
| Massa Molare (HClO4) | ? | g/mol | Massa Molare (HClO4) | ? | g/mol |
| Massa Solvente | ? | Kg | |||
| Massa Soluzione | ? | Kg | |||
| Volume | ? | L | |||
| Densità | 1,18 | g/mL(cm3) | Densità | 1,18 | g/mL(cm3) |
TAPPA 1: Stabiliamo la massa del solvente e moli di soluto di riferimento
Abbiamo una situazione analoga a quella dell'esercizio precedente ci viene data solo la molalità e non la massa di solvente in cui il soluto è sciolto. Anche questa volta non è assolutamente un problema. Consideriamo come massa di solvente quella di riferimento nella definizione di molalità, 1 chilogrammo di solvente, in modo da avere direttamente il numero di moli di soluto da utilizzare nelle due concentrazioni.
m=n/Kg --> m=n/1(chilo) --> m=n
In conclusione se noi sciogliamo il soluto in un chilogrammo di solvente la molalità (m) è semplicemente uguale al numero di moli di soluto (n)
Sostituiamo nella tabella
| Ignota (Molarità) | Nota (Molalità) | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | ? | mol/L | Molalità | 0,175 | mol/Kg |
| Numero di Moli | 0,175 | mol | Numero di Moli | 0,175 | mol |
| Massa in grammi | ? | g | Massa in grammi | ? | g |
| Massa Molare (HClO4) | ? | g/mol | Massa Molare (HClO4) | ? | g/mol |
| Massa Solvente | 1 | Kg | |||
| Massa Soluzione | ? | Kg | |||
| Volume | ? | L | |||
| Densità | 1,18 | g/mL(cm3) | Densità | 1,18 | g/mL(cm3) |
TAPPA 2: Calcoliamo la massa molare del soluto
NB: Ora ci serve la massa della soluzione in modo da usare poi la densità per ottenere il volume della stessa.La massa del solvente la conosciamo e ci manca la massa del soluto.
Procediamo come abbiamo fatto negli esercizi precedenti e calcoliamo per prima cosa la massa molare dell'acido perclorico: Usiamo come al solito la tavola periodica, o il calcolatore in fondo alla pagina.
La formula dell'acido perclorico è HClO4
Dalla tavola periodica leggiamo che le masse molari approssimate dei singoli elementi sono (H = 1,008; Cl = 35,45; O =16):
per cui
Massa molare di HClO4 = (H) (1,008x1) + (Cl) (35,45x1) + (O) (16x4) = 100,46 g/mol
Inseriamo il valore nella tabella
| Ignota (Molarità) | Nota (Molalità) | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | ? | mol/L | Molalità | 0,175 | mol/Kg |
| Numero di Moli | 0,175 | mol | Numero di Moli | 0,175 | mol |
| Massa in grammi | mg=nxMm | g | Massa in grammi | mg=nxMm | g |
| Massa Molare (HClO4) | 100,46 | g/mol | Massa Molare (HClO4) | 100,46 | g/mol |
| Massa Solvente | 1 | Kg | |||
| Massa Soluzione | ? | Kg | |||
| Volume | ? | L | |||
| Densità | 1,18 | g/mL(cm3) | Densità | 1,18 | g/mL(cm3) |
TAPPA 3: Calcolare la massa in grammi di HClO4
Usiamo la formula inserita nella tabella per calcolare il numero di grammi di HClO4 sciolti nella soluzione
mg=n.Mm --> 0,175(mol) x 100,46 g/mol --> 17,58 g
Inseriamo il valore nella tabella
| Ignota (Molarità) | Nota (Molalità) | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | ? | mol/L | Molalità | 0,175 | mol/Kg |
| Numero di Moli | 0,175 | mol | Numero di Moli | 0,175 | mol |
| Massa in grammi | 17,58 | g | Massa in grammi | 17,58 | g |
| Massa Molare (HClO4) | 100,46 | g/mol | Massa Molare (HClO4) | 100,46 | g/mol |
| Massa Solvente | 1 | Kg | |||
| Massa Soluzione | msolvente + msoluto | Kg | |||
| Volume | ? | L | |||
| Densità | 1,18 | g/mL(cm3) | Densità | 1,18 | g/mL(cm3) |
TAPPA 4: Calcolare la massa totale della soluzione
Usiamo la formula inserita nella tabella per calcolare la massa in grammi della soluzione, in modo da trovare il volume, necessario per la Molarità, utilizzando la densità
msoluzione=msolvente + msoluto --> 1000 + 0,018 --> 1018 g
Inseriamo il valore nella tabella
| Ignota (Molarità) | Nota (Molalità) | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | ? | mol/L | Molalità | 0,175 | mol/Kg |
| Numero di Moli | 0,175 | mol | Numero di Moli | 0,175 | mol |
| Massa in grammi | 17,58 | g | Massa in grammi | 17,58 | g |
| Massa Molare (HClO4) | 100,46 | g/mol | Massa Molare (HClO4) | 100,46 | g/mol |
| Massa Solvente | 1 | Kg | |||
| Massa Soluzione | 1018 | g | |||
| Volume | V=m/d | L | |||
| Densità | 1,18 | g/mL(cm3) | Densità | 1,18 | g/mL(cm3) |
TAPPA 5: Calcola il volume della soluzione
Usiamo la formula inversa della densità
d=m/V --> V=m/d
Per calcolare il volume e trasformiamo i millilitri in litri per usare il valore nel calcolo della molarità
V=1018/1,18 --> 862,71 mL --> 0,863 L
Inseriamo il valore nella tabella
| Ignota (Molarità) | Nota (Molalità) | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | M=n/V | mol/L | Molalità | 0,175 | mol/Kg |
| Numero di Moli | 0,175 | mol | Numero di Moli | 0,175 | mol |
| Massa in grammi | 17,58 | g | Massa in grammi | 17,58 | g |
| Massa Molare (HClO4) | 100,46 | g/mol | Massa Molare (HClO4) | 100,46 | g/mol |
| Massa Solvente | 1 | Kg | |||
| Massa Soluzione | 1018 | g | |||
| Volume | 0,863 | L | |||
| Densità | 1,18 | g/mL(cm3) | Densità | 1,18 | g/mL(cm3) |
TAPPA 5: Calcola la Molarità
Ora che abbiamo numero di moli di soluto e volume della soluzione in litri possiamo sostituire alla formula riportata in tabella e ricavare la molarità della soluzione!
Mmolarità=nmoli soluto/V --> M=0,175/0,863 = 0,203 M
Quindi la nostra soluzione è 0,20 molare.
| Molarità | Molalità | ||||
|---|---|---|---|---|---|
| Grandezza | Valore | Unità di misura | Grandezza | Valore | Unità di misura |
| Molarità | 0,203 | mol/L | Molalità | 0,175 | mol/Kg |
In questo caso i valori di molalità e molarità si discostano sensibilmente a differenza dell'esercizio precedente
Ora siete in grado di convertire i valori della molarità in molalità e viceversa, a patto, ovviamente, di conoscere la densità della soluzione.
Nelle prossime pagine ci occuperemo delle concentrazioni percentuali.
Pagina precedente - esercizi svolti da molarità a molalità
Pagina successiva - Le concentrazioni percentuali
Concentrazioni delle soluzioni chimiche
Calcolo della Molarità, delle moli e Numero di Avogadro - teoria e calcolatore online
molalità e concentrazione molale
esercizi svolti sulla molarità (1)
esercizi svolti sulla molarità (2)
esercizi svolti sulla molalità (1)
esercizi svolti sulla molalità (2)
esercizi svolti sulla molalità (3)
esercizi svolti da molarità a molalità
esercizi svolti da molalità a molarità
Le concentrazioni percentuali m/m esercizi svolti
Altri argomenti di chimica
Bilanciamento delle reazioni chimiche
Altri convertitori
Calcolo della Molarità, delle moli e Numero di Avogadro - teoria e calcolatore online